a) son los "instrumentos moleculares" mediante los cuales se expresa la información genética; es decir, las proteínas ejecutan las órdenes dictadas por los ácidos nucléicos.
b) son sustancias "plásticas" para los seres vivos, es decir, materiales de construcción y reparación de sus propias estructuras celulares. Sólo excepcionalmente sirven como fuente de energía.
c) muchas tienen "actividad biológica" (transporte, regulación, defensa, reserva, etc.). Esta característica diferencia a las proteínas de otros principios inmediatos como glúcidos y lípidos que se encuentran en las células como simples sustancias inertes.
Composición Química y Clasificación
Las proteínas son biopolímeros (macromoléculas orgánicas), de elevado peso molecular, constituidas básicamente por carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); aunque pueden contener también azufre (S) y fósforo (P) y, en menor proporción, hierro (Fe), cobre (Cu), magnesio (Mg), yodo (Y), etc.
Estos elementos químicos se agrupan para formar unidades estructurales (monómeros) llamados Aminoácidos, a los cuales podríamos considerar como los "ladrillos de los edificios moleculares proteicos". Estos edificios macromoleculares se construyen y desmoronan con gran facilidad dentro de las células, y a ello debe precisamente la materia viva su capacidad de crecimiento, reparación y regulación.
Las proteínas son, en resumen, biopolímeros de aminoácidos y su presencia en los seres vivos es indispensable para el desarrollo de los múltiples procesos vitales. Se clasifican, de forma general, en Holoproteinas y Heteroproteinas según estén formadas respectivamente sólo por aminoácidos o bien por aminoácidos más otras moléculas o elementos adicionales no aminoacídicos.
 |
| Grupo porfirínico hemo de la hemoglobina, una heteroproteína |
Los aminoácidos
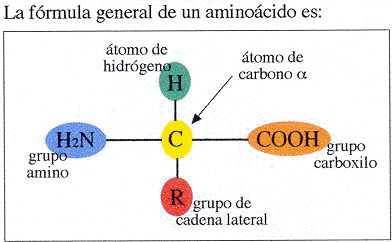
Son las unidades básicas que forman las proteínas. Su denominación responde a la composición química general que presentan, en la que un grupo amino (-NH2) y otro carboxilo o ácido (-COOH) se unen a un carbono (-C-). Las otras dos valencias de ese carbono quedan saturadas con un átomo de hidrógeno (-H) y con un grupo químico variable al que se denomina radical (-R).
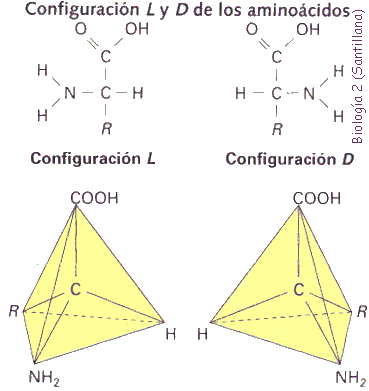
Tridimensionalmente el carbono presenta una configuración tetraédrica en la que el carbono se dispone en el centro y los cuatro elementos que se unen a él ocupan los vértices. Cuando en el vértice superior se dispone el -COOH y se mira por la cara opuesta al grupo R, según la disposición del grupo amino (-NH2) a la izquierda o a la derecha del carbono se habla de " -L-aminoácidos o de " -D-aminoácidos respectivamente. En las proteínas sólo se encuentran aminoácidos de configuración L.
En la naturaleza existen unos 80 aminoácidos diferentes, pero de todos ellos sólo unos 20 forman parte de las proteínas.

Como vemos en la tabla tenemos aminoácidos apolares, polares sin carga y polares con carga.
Los aminoácidos que un organismo no puede sintetizar y, por tanto, tienen que ser suministrados con la dieta se denominan aminoácidos esenciales; y aquellos que el organismo puede sintetizar se llaman aminoácidos no esenciales.
Para la especie humana son esenciales ocho aminoácidos: treonina, metionina, lisina, valina, triptófano, leucina, isoleucina y fenilalanina (además puede añadirse la histidina como esencial durante el crecimiento, pero no para el adulto).
Propiedades de los aminoácidos
Los aminoácidos son compuestos sólidos; incoloros; cristalizables; de elevado punto de fusión (habitualmente por encima de los 200 ºC); solubles en agua; con actividad óptica y con un comportamiento anfótero. La actividad óptica se manifiesta por la capacidad de desviar el plano de luz polarizada que atraviesa una disolución de aminoácidos, y es debida a la asimetría del carbono , ya que se halla unido (excepto en la glicina) a cuatro radicales diferentes. Esta propiedad hace clasificar a los aminoácidos en Dextrogiros (+) si desvían el plano de luz polarizada hacia la derecha, y Levógiros (-) si lo desvían hacia la izquierda. El comportamiento anfótero se refiere a que, en disolución acuosa, los aminoácidos son capaces de ionizarse, dependiendo del pH, como un ácido (cuando el pH es básico), como una base (cuando el pH es ácido) o como un ácido y una base a la vez (cuando el pH es neutro). En este último caso adoptan un estado dipolar iónico conocido como zwitterión.
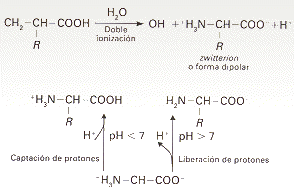
El pH en el cual un aminoácido tiende a adoptar una forma dipolar neutra (igual número de cargas positivas que negativas) se denomina Punto Isoeléctrico. La solubilidad en agua de un aminoácido es mínima en su punto isoeléctrico.
Péptidos y Enlace peptídico
Los péptidos son cadenas lineales de aminoácidos enlazados por enlaces químicos de tipo amídico a los que se denomina Enlace Peptídico. Así pues, para formar péptidos los aminoácidos se van enlazando entre sí formando cadenas de longitud y secuencia variable. Para denominar a estas cadenas se utilizan prefijos convencionales como:
a) Oligopéptidos.- si el nº de aminoácidos es menor 10.
• Dipéptidos.- si el nº de aminoácidos es 2.
• Tripéptidos.- si el nº de aminoácidos es 3.
• Tetrapéptidos.- si el nº de aminoácidos es 4.
• etc...
b) Polipéptidos o cadenas polipeptídicas.- si el nº de aminoácidos es mayor 10.
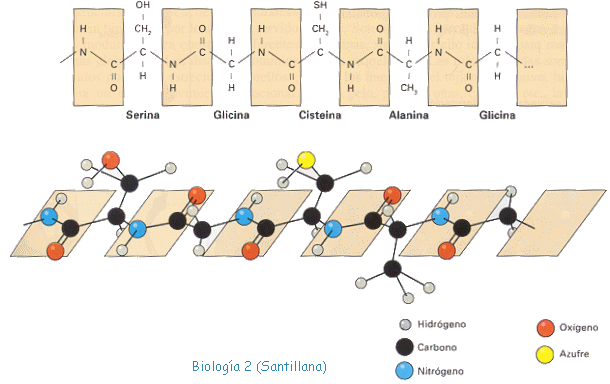
Cada péptido o polipéptido se suele escribir, convencionalmente, de izquierda a derecha, empezando por el extremo N-terminal que posee un grupo amino libre y finalizando por el extremo C-terminal en el que se encuentra un grupo carboxilo libre, de tal manera que el eje o esqueleto del péptido, formado por una unidad de seis átomos (-NH-CH-CO-), es idéntico a todos ellos. Lo que varía de unos péptidos a otros, y por extensión, de unas proteínas a otras, es el número, la naturaleza y el orden o secuencia de sus aminoácidos.
El enlace peptídico es un enlace covalente y se establece entre el grupo carboxilo (-COOH) de un aminoácido y el grupo amino (-NH2) del aminoácido contiguo inmediato, con el consiguiente desprendimiento de una molécula de agua.
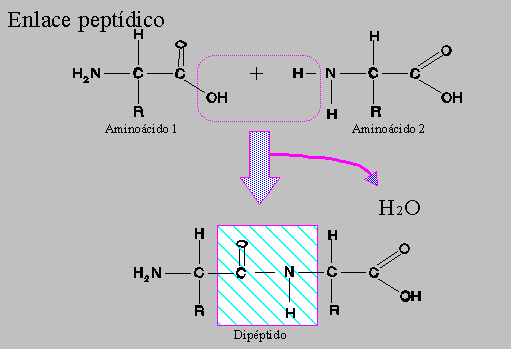
Por otra parte, el carácter parcial de doble enlace del enlace peptídico (-C-N-) determina la disposición espacial de éste en un mismo plano, con distancias y ángulos fijos. Como consecuencia, el enlace peptídico presenta cierta rigidez e inmoviliza en el plano a los átomos que lo forman.
Estructura tridimensional
La estructura tridimensional de una proteína es un factor determinante en su actividad biológica. Tiene un carácter jerarquizado, es decir, implica unos niveles de complejidad creciente que dan lugar a 4 tipos de estructuras: primaria, secundaria, terciaria y cuaternaria.
Cada uno de estos niveles se construye a partir del anterior.
La Estructura primaria esta representada por la sucesión lineal de aminoácidos que forman la cadena peptídica y por lo tanto indica qué aminoácidos componen la cadena y el orden en que se encuentran. El ordenamiento de los aminoácidos en cada cadena peptídica, no es arbitrario sino que obedece a un plan predeterminado en el ADN.
Esta estructura define la especificidad de cada proteína.
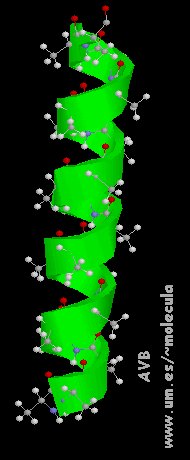
La Estructura secundaria está representada por la disposición espacial que adopta la cadena peptídica (estructura primaria) a medida que se sintetiza en los ribosomas. Es debida a los giros y plegamientos que sufre como consecuencia de la capacidad de rotación del carbono y de la formación de enlaces débiles (puentes de hidrógeno).
Las formas que pueden adoptar son:
a) Disposición espacial estable determina formas en espiral (configuración -helicoidal y las hélices de colágeno)
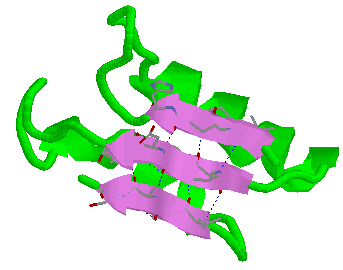
b) Formas plegadas (configuración o de hoja plegada).
c) También existen secuencias en el polipéptido que no alcanzan una estructura secundaria bien definida y se dice que forman enroscamientos aleatorios.
La Estructura terciaria esta representada por los superplegamientos y enrollamientos de la estructura secundaria, constituyendo formas tridimensionales geométricas muy complicadas que se mantienen por enlaces fuertes (puentes disulfuro entre dos cisteínas) y otros débiles (puentes de hidrógeno; fuerzas de Van der Waals; interacciones iónicas e interacciones hidrofóbicas).
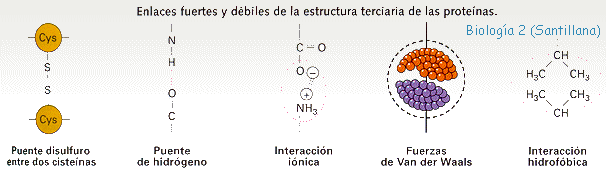
Desde el punto de vista funcional, esta estructura es la más importante pues, al alcanzarla es cuando la mayoría de las proteínas adquieren su actividad biológica o función.
Muchas proteínas tienen estructura terciaria globular caracterizada por ser soluble en disoluciones acuosas, como la mioglobina o muchos enzimas.
Sin embargo, no todas las proteínas llegan a formar estructuras terciarias. En estos casos mantienen su estructura secundaria alargada dando lugar a las llamadas proteínas filamentosas, que son insolubles en agua y disoluciones salinas siendo por ello idóneas para realizar funciones esqueléticas. Entre ellas, las más conocidas son el colágeno de los huesos y del tejido conjuntivo; la -queratina del pelo, plumas, uñas, cuernos, etc.; la fibroina del hilo de seda y de las telarañas y la elastina del tejido conjuntivo, que forma una red deformable por la tensión.
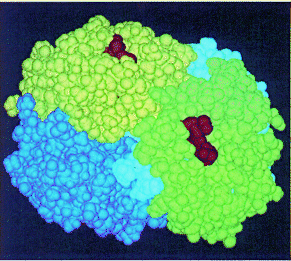
La Estructura cuaternaria está representada por el acoplamiento de varias cadenas polipeptídicas, iguales o diferentes, con estructuras terciarias (protómeros) que quedan autoensambladas por enlaces débiles, no covalentes. Esta estructura no la poseen, tampoco, todas las proteínas. Algunas que sí la presentan son: la hemoglobina y los enzimas alostéricos.
Propiedades de las proteínas
Solubilidad
Las proteínas son solubles en agua cuando adoptan una conformación globular. La solubilidad es debida a los radicales (-R) libres de los aminoácidos que, al ionizarse, establecen enlaces débiles (puentes de hidrógeno) con las moléculas de agua. Así, cuando una proteína se solubiliza queda recubierta de una capa de moléculas de agua (capa de solvatación) que impide que se pueda unir a otras proteínas lo cual provocaría su precipitación (insolubilización). Esta propiedad es la que hace posible la hidratación de los tejidos de los seres vivos.
Capacidad amortiguadora
Las proteínas tienen un comportamiento anfótero y esto las hace capaces de neutralizar las variaciones de pH del medio, ya que pueden comportarse como un ácido o una base y por tanto liberar o retirar protones (H+) del medio donde se encuentran.
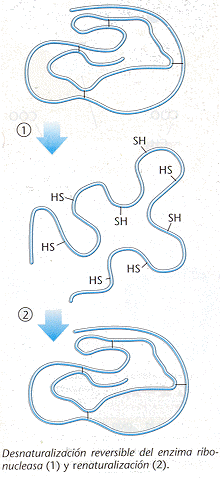
Desnaturalización y renaturalización
La desnaturalización de una proteína se refiere a la ruptura de los enlaces que mantenían sus estructuras cuaternaria, terciaria y secundaria, conservándose solamente la primaria. En estos casos las proteínas se transforman en filamentos lineales y delgados que se entrelazan hasta formar compuestos fibrosos e insolubles en agua. Los agentes que pueden desnaturalizar a una proteína pueden ser: calor excesivo; sustancias que modifican el pH; alteraciones en la concentración; alta salinidad; agitación molecular; etc. El efecto más visible de éste fenómeno es que las proteínas se hacen menos solubles o insolubles y que pierden su actividad biológica.
La mayor parte de las proteínas experimentan desnaturalizaciones cuando se calientan entre 50 y 60 ºC; otras se desnaturalizan también cuando se enfrían por debajo de los 10 a 15 ºC.
La desnaturalización puede ser reversible (renaturalización) pero en muchos casos es irreversible.
Especificidad
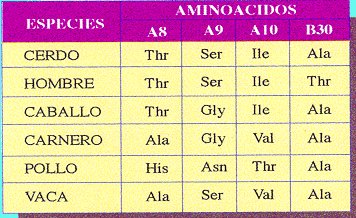
Es una de las propiedades más características y se refiere a que cada una de las especies de seres vivos es capaz de fabricar sus propias proteínas (diferentes de las de otras especies) y, aún, dentro de una misma especie hay diferencias proteicas entre los distintos individuos. Esto no ocurre con los glúcidos y lípidos, que son comunes a todos los seres vivos.
La enorme diversidad proteica interespecífica e intraespecífica es la consecuencia de las múltiples combinaciones entre los aminoácidos, lo cual está determinado por el ADN de cada individuo.
La especificidad de las proteínas explica algunos fenómenos biológicos como: la compatibilidad o no de transplantes de órganos; injertos biológicos; sueros sanguíneos; etc. o los procesos alérgicos e incluso algunas infecciones.
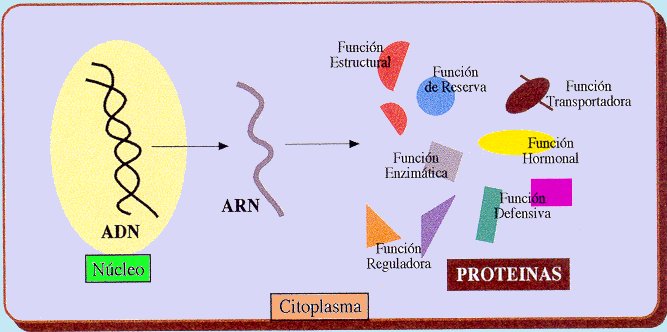
Funciones de las proteínas
Las proteínas determinan la forma y la estructura de las células y dirigen casi todos los procesos vitales. Las funciones de las proteínas son específicas de cada una de ellas y permiten a las células mantener su integridad, defenderse de agentes externos, reparar daños, controlar y regular funciones, etc. Todas las proteínas realizan su función de la misma manera: por unión selectiva a moléculas. Las proteínas estructurales se agregan a otras moléculas de la misma proteína para originar una estructura mayor. Sin embargo, otras proteínas se unen a moléculas distintas: los anticuerpos a los antígenos específicos, la hemoglobina al oxígeno, las enzimas a sus sustratos, los reguladores de la expresión génica al ADN, las hormonas a sus receptores específicos, etc.
A continuación se exponen algunos ejemplos de proteínas y las funciones que desempeñan:
Función estructural
- Algunas proteínas constituyen estructuras celulares:
• Ciertas glucoproteínas forman parte de las membranas celulares y actúan como receptores o facilitan el transporte de sustancias.
• Las histonas, forman parte de los cromosomas que regulan la expresión de los genes.
- Otras proteínas confieren elasticidad y resistencia a órganos y tejidos:
• El colágeno del tejido conjuntivo fibroso.
• La elastina del tejido conjuntivo elástico.
• La queratina de la epidermis.
- Las arañas y los gusanos de seda segregan fibroina para fabricar las telas de araña y los capullos de seda, respectivamente.
Función enzimática
- Las proteínas con función enzimática son las más numerosas y especializadas. Actúan como biocatalizadores de las reacciones químicas del metabolismo celular.
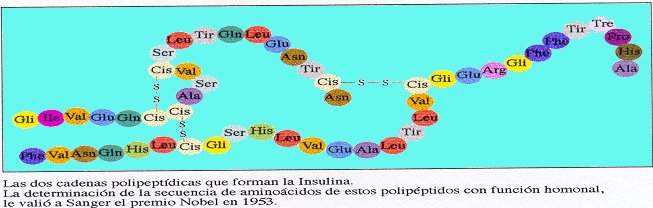
Función hormonal
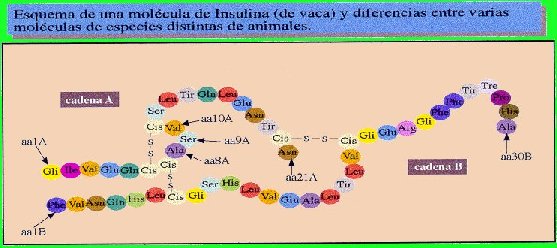
- Algunas hormonas son de naturaleza proteica, como la insulina y el glucagón (que regulan los niveles de glucosa en sangre) o las hormonas segregadas por la hipófisis como la del crecimiento o la adrenocorticotrópica (que regula la síntesis de corticosteroides) o la calcitonina (que regula el metabolismo del calcio).
Función reguladora
- Algunas proteínas regulan la expresión de ciertos genes y otras regulan la división celular (como la ciclina).
Función homeostática
- Algunas mantienen el equilibrio osmótico y actúan junto con otros sistemas amortiguadores para mantener constante el pH del medio interno.
Función defensiva
• Las inmunoglobulinas actúan como anticuerpos frente a posibles antígenos.
• La trombina y el fibrinógeno contribuyen a la formación de coágulos sanguíneos para evitar hemorragias.
• Las mucinas tienen efecto germicida y protegen a las mucosas.
• Algunas toxinas bacterianas, como la del botulismo, o venenos de serpientes, son proteínas fabricadas con funciones defensivas.
Función de transporte
• La hemoglobina transporta oxígeno en la sangre de los vertebrados.
• La hemocianina transporta oxígeno en la sangre de los invertebrados.
• La mioglobina transporta oxígeno en los músculos.
• Las lipoproteínas transportan lípidos por la sangre.
• Los citocromos transportan electrones.
Función contráctil
• La actina y la miosina constituyen las miofibrillas responsables de la contracción muscular.
• La dineina está relacionada con el movimiento de cilios y flagelos.
Función de reserva
• La ovoalbúmina de la clara de huevo, la gliadina del grano de trigo y la hordeina de la cebada, constituyen la reserva de aminoácidos para el desarrollo del embrión.
• La lactoalbúmina de la leche.
Enzimas
La actividad vital no es más que el desarrollo de una serie de reacciones químicas entre un conjunto de moléculas. Si un químico en un laboratorio realiza estas reacciones lo normal es que el rendimiento (cuantificado como la cantidad de producto deseado frente a la cantidad total del producto) sea muy bajo, mientras que esta misma reacción en un sistema biológico tiene un rendimiento del 99% y se realiza a una mayor velocidad. Esto se debe a la existencia de catalizadores , la mayoría de los catalizadores biológicos que se conocen son Enzimas.
Las enzimas son proteínas altamente especializadas que tienen como función la catálisis o regulación de la velocidad de las reacciones químicas que se llevan a cabo en los seres vivos.
Casi todas las reacciones químicas de las células son catalizadas por enzimas, con la particularidad de que cada enzima solo cataliza una reacción, por lo que existirían tantas enzimas como reacciones, y no se consumen en el proceso. Los catalizadores no biológicos son inespecíficos.
En una reacción catalizada por enzima (E), los reactivos se denominan sustratos (S) , es decir la sustancia sobre la que actúa la enzima. El sustrato es modificado químicamente y se convierte en uno o más productos (P). Como esta reacción es reversible se expresa de la siguiente manera:
La enzima libre se encuentra en la misma forma química al comienzo y al final de la reacción.
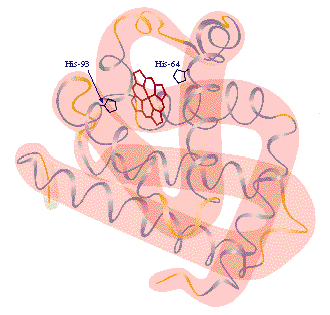
Especificidad
Las moléculas del sustrato se unen a un sitio particular en la superficie de la enzima, denominado sitio activo, donde tiene lugar la catálisis. La estructura tridimensional de este sitio activo, donde solo puede entrar un determinado sustrato (ni siquiera sus isómeros) es lo que determina la especificidad de las enzimas. El acoplamiento es tal que E. Fisher (1894) enunció: "el sustrato se adapta al centro activo o catalítico de una enzima como una llave a una cerradura".
Clases de Enzimas
El nombre de las enzimas es el del sustrato + el sufijo: -asa. Los nombres de las enzimas revelan la especificidad de su función:
- Oxido-reductasas: catalizan reacciones de oxido-reducción, las que implican la ganancia (o reducción) o pérdida de electrones (u oxidación). Las más importantes son las deshidrogenasas y las oxidasas.
- Transferasas: transfieren grupos funcionales de una molécula a otra. Ej.: quinasas; transfieren fosfatos del ATP a otra molécula.
- Hidrolasas: rompen varios tipos de enlaces introduciendo radicales -H y -OH.
- Liasas: adicionan grupos funcionales a los dobles enlaces.
- Isomerasas: convierten los sustratos isómeros unos en otros.
- Ligasas o Sintasas: forman diversos tipos de enlaces aprovechando la energía de la ruptura del ATP. Ej: polimerasas.
Mecanismo de acción enzimática
Una enzima, por sí misma, no puede llevar a cabo una reacción, su función es modificar la velocidad de la reacción, entendiéndose como tal la cantidad de producto formado por unidad de tiempo. Tal variación se debe a la disminución de la energía de activación Ea; en una reacción química, la Ea es la energía necesaria para convertir los reactivos en formas moleculares inestables denominadas especies en estado de transición, que poseen mayor energía libre que los reactivos y los productos.
 |
| Imagen original de la Universidad de Virginia |
En el diagrama están representados los niveles de energía , durante el curso de la reacción, de moléculas intervinientes en una reacción tipo: A + B ---> C. La curva azul muestra el curso de la reacción en ausencia de una enzima que facilite la reacción, mientras que la curva roja la muestra en presencia de la enzima específica de la reacción. La diferencia en el nivel de energía entre el estado inicial y la necesaria para iniciar la reacción (picos de las curvas) es la energía de activación. Tal como se observa la presencia de enzima baja la energía de activación.
El complejo Enzima- sustrato posee menor energía de activación que las especies en estado de transición que la correspondiente reacción no catalizada.
Como realiza esta acción una enzima?
- Orienta a los sustratos: parte de la energía de activación se utiliza para que los sustratos roten y se enfrenten con los átomos correctos para formar los enlaces.
- Agregan cargas a los sustratos: las cadenas laterales (R) de los aminoácidos de las enzimas pueden participar directamente haciendo a los sustratos químicamente más reactivos.
- Inducen la deformación en el sustrato: cuando una sustancia se une al sitio activo, la enzima puede causar que los los enlaces se estiren, poniéndolo en un estado de transición inestable.
- Cambio de forma de la enzima al unirse al sustrato: el modelo de llave- cerradura de Fisher fue actualizado cuando se descubrió que las enzimas son flexibles y sus sitios activos pueden cambiar (expandirse) para acomodarse a sus sustratos. Este cambio de forma causado por la unión al sustrato se denomina ajuste inducido.
Acompañantes no proteicos de las enzimas
Ya sea que consistan en una única cadena polipeptídica plegada o en varias unidades, muchas enzimas requieren otras moléculas no proteicas para funcionar.
1. Cofactores: son iones inorgánicos que se unen temporariamente a las enzimas.
molécula
|
papel en la reacción catalizada
|
Hierro Fe 2+ o Fe 3+
|
Oxidación / reducción
|
Cobre, Cu + o Cu 2+
|
Oxidación / reducción
|
Cinc, Zn2+
|
Ayuda a unir el NAD
|
molécula
|
papel en la reacción catalizada
|
Biotina
|
transporta -COO-
|
Coenzima A
|
transporta -CH2-CH3
|
NAD y FAD
|
transportan electrones
|
3. Grupos prostéticos: están permanentemente unidos a las enzimas.
molécula
|
papel en la reacción catalizada
|
Hemo
|
une iones O2 y electrones, contiene el
cofactor hierro
|
Flavina
|
Une electrones
|
Retinal
|
Cofactor en la absorción de la luz
|
Las coenzimas reaccionan con la enzima de igual modo que el sustrato, uniéndose al sitio activo. Se mueven de una enzima a otra agregando o quitando grupos químicos del sustrato.
Regulación enzimática
El metabolismo consiste en una serie de reacciones catalizadas por enzimas, donde los productos de una reacción se convierten en los reactivos de la siguiente, lo que se conoce como vías metabólicas.
Las células deben poder regular estas vías metabólicas y lo hacen a través de reguladores enzimáticos. los inhibidores naturales regulan el metabolismo mientras que los artificiales son utilizados por la medicina, para destruir plagas, etc.
Inhibición reversible: pueden inhibidores competitivos, los que se unen a la enzima ingresando en el sitio activo, impidiendo así su enlace con el sustrato. Los inhibidores no competitivos se unen a la enzima en un lugar diferente al sitio activo cambiando la forma de la proteína y por lo tanto la forma del sitio activo. Sus efectos son reversibles.
Inhibición irreversible: hay inhibidores que se unen covalentemente al sitio activo de una enzima, esta unión es permanente e inactiva a la enzima destruyendo su capacidad de unirse al sustrato. Ej: el DIPF reacciona con el aminoácido serina del sitio activo de la enzima acetilcolinesterasa, inhibiéndola irreversiblemente. Esta enzima participa en el mecanismo de propagación de los impulsos nerviosos. El DIPF es conocido como gas nervioso, algunos ej. son la SARINA (usado en el ataque terrorista en un subte en Tokio en 1995)y el Malation (insecticida).
El gas nervioso ejerce su efecto letal al unirse con la enzima Acetilcolinesterasa, que es la encargada de disociar la molécula de Acetilcolina para su posterior síntesis. Este proceso no se puede llevar a cabo sin la primera disociación y sus consecuencias son trágicas. Al no poder ser sintetizada, la Acetilcolina comienza a acumularse en los centros de transmisión, como entre neuronas, ganglios, uniones neuromusculares, impidiendo la transmisión de ordenes a los músculos tanto de acción voluntaria como de acción involuntaria. Así, todos los músculos quedan bloqueados. Los primeros síntomas son un sudor copioso, dificultad en la respiración, presión en el pecho, fallos respiratorios, mareos, perdida de visión... Al aumentar la dosis de gas nervioso los efectos son cada vez mayores, llegando a producir espasmos y la perdida de la conciencia casi en el acto. Finalmente la muerte se produce tras pocos minutos por asfixia. Entre los antídotos, con el fin de reactivar el proceso de síntesis a cargo de la encima acetilcolina, el mas usado es el basado en la Atropina, dado que es el único eficaz si se aplica con extrema rapidez.
Fuente: http://www.biologia.edu.ar/metabolismo/enzimas.htm



