Muchas proteínas ejercen a la vez más de una de las funciones enumeradas: Las proteínas de membrana tienen tanto función estructural como enzimática; la ferritina es una proteína que transporta y, a la vez, almacena el hierro; la miosina interviene en la contracción muscular, pero también funciona como un enzima capaz de hidrolizar el ATP, y así se podrían poner muchos ejemplos más.
La estructura de las proteínas
Los aminoácidos unidos forman una proteína, pero no permanecen alineados en el espacio. Las cadenas polipeptídicas (hileras de aminoácidos) adoptan en el espacio diferentes ubicaciones. Esta forma o configuración depende de los aminoácidos que las integran. Entonces, una vez formado un polipéptido, se pliega y adquiere su estructura en el espacio, tridimensional, que le permitirá interaccionar con otras moléculas y cumplir con su función específica. Solo cuando un polipéptido adquiere su estructura espacial definitiva, se habla de proteína.
Ahora bien, los aminoácidos se unen formando cadenas largas de secuencias diferentes, es decir que pueden estar unidos en diferente orden. Y es ese orden o secuencia el que va a determinar la forma en que la proteína se plegará y, de acuerdo con esto, la función que va a cumplir. Si cambia la secuencia, es otra proteína y también se modifica la función.
Entonces, las largas cadenas polipeptídicas se combinan y se pliegan.
Podemos analizar la estructura de una proteína teniendo en cuenta cuatro niveles de organización sucesivos: estructura primaria, secundaria, terciaria y cuaternaria.
Estructura primaria: La estructura primaria es la secuencia lineal de los aminoácidos que forman la proteína. Está determinada genéticamente. Indica que aminoácidos son y en qué orden se encuentran en la cadena proteica. Las propiedades de la proteína van a estar dadas por el número y el orden o secuencia en que se enlazan los aminoácidos, ya que si hay un cambio en la estructura primaria de una proteína, esta será diferente y no cumplirá su función biológica.
Estructura secundaria: Cuando la cadena se va formando, comienzan las interacciones entre los aminoácidos que la constituyen: estos se unen por medio de enlaces químicos y forman cadenas polipeptídicas que se pliegan y logran una disposición espacial estable. De esta manera, pueden construir dos posibles conformaciones o estructuras: la alfa-hélice y la beta-hoja plegada.
La alfa-hélice se forma a partir de la cadena primaria que se enrolla sobre sí misma, en forma helicoidal, como un tirabuzón.
La beta-hoja plegada presenta una conformación en zigzag, donde las cadenas de polipéptidos son paralelas o se cruzan uniéndose mediante enlaces que les dan estabilidad, a la manera de un acordeón.
Los aminoácidos que se encuentran en las estructuras secundarias diferentes pueden interaccionar aunque estén alejados entre sí.
Estructura terciaria: La estructura terciaria se forma por plegamientos de cadenas de estructura secundaria en las que interaccionan los grupos R de los aminoácidos. Es el modo en que las cadenas secundarias se pliegan tridimensionalmente en el espacio formando una estructura más compleja que la secundaria. En muchas proteínas, esta estructura les otorga una forma una forma globular, en cambio otras son fibrosas. Las proteínas en estructura terciaria son las que realizan la mayoría de las funciones biológicas.
Estructura cuaternaria: Muchas proteínas presentan una estructura cuaternaria en la que se combinan y se interconectan varias cadenas polipeptídicas de estructura terciaria, que forman un complejo proteico. Estas proteínas se llaman ¨multiméricas¨ y, según el número se cadenas polipetídicas que las forman, tienen otra denominación. Por ejemplo, la hemoglobina es tetrámero, porque es una proteína formada por cuatro subunidades (cadenas) proteicas que tienen cada una su propia estructura terciaria.
En resumen, podemos decir que la cadena primaria no tiene funcionalidad; de la primaria a la terciaria, la molécula es cada vez más compleja y está más plegada; la cuaternaria se forma con asociaciones de cadenas terciarias.
Resumiendo:
Clasificación de las proteínas
La clasificación de las proteínas se realiza desde varios puntos de vista, así:
1. Según su composición:
Proteínas simples u Holoproteínas: Las cuales están formadas exclusivamente o predominantemente por aminoácidos.
Proteínas conjugadas: Poseen un componente de proporción significativa no aminoacídico que recibe el nombre de grupo prostético. Según la naturaleza de este grupo consideramos:
- Glicoproteínas: Se caracterizan por poseer en su estructura azúcares. Se pueden citar como ejemplo: las inmunoglobulinas, algunas proteínas de membrana, el colágeno y otras proteínas de tejidos conectivos (glucosaminoglicanos).
- Lipoproteínas: Proteínas conjugadas con lípidos que se encuentran en las membranas celulares.
- Nucleoproteínas: Se presentan unidas a un ácido nucleico, como en los cromosomas, ribosomas y en los virus.
- Metaloproteínas: Contienen en su molécula uno o más iones metálicos que no constituyen un grupo hem. Por ejemplo algunas enzimas.
- Hemoproteínas o Cromoproteínas: Proteínas que tienen en su estructura un grupo hem (Figura). Ejemplo: Hemoglobina, Mioglobina y ciertas enzimas como los citocromos.
2. De acuerdo con su morfología y solubilidad:
- Proteínas fibrosas: Son insolubles en agua, presentan formas moleculares alargadas, con un número variado de cadenas polipeptídicas que constituyen fibras resistentes, con cierto grado de elasticidad, fragilidad o ductilidad. Funcionan como proteínas estructurales o de soporte. Las más comunes son: Elastina, Colágeno, Queratina, Fibrina, etc.
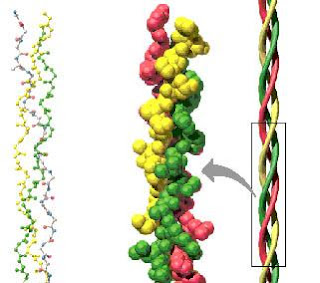 |
La unidad esencial del colágeno está constituida por tres cadenas de polipéptidos que aparecen entralazadas formando una triple hélice, constituyendo una unidad macromolecular denominada tropocolágeno
- Proteínas Globulares: Tienden a ser más solubles en agua, debido a que su superficie es polar. Sin embargo, pueden presentar mayor solubilidad en otros solventes como soluciones salinas, ácidos o bases diluidas o alcohol. Su estructura es compacta con formas casi esféricas. La mayoría de las proteínas conocidas son globulares, dentro de las que se consideran todas las enzimas, las proteínas del plasma y las presentes en las membranas celulares. A su vez las proteínas globulares se pueden clasificar de acuerdo con su solubilidad:
- Albúminas: Proteínas fácilmente solubles en agua, que coagulan con el calor y precipitan con las soluciones salinas saturadas. Por ejemplo la Lactoalbúmina, albúmina del suero, la ovoalbúmina (presente en la clara del huevo).
- Globulinas: Escasamente solubles en agua pura, pero solubles en soluciones salinas diluidas como cloruro de sodio, entre ellas se encuentran las seroglobulinas (sangre), ovoglobulina, inmunoglobulinas, etc.
- Glutelinas: Solubles en ácidos y bases diluidos, insolubles en solventes neutros. Ejemplo: La Glutenina del trigo.
- Prolaminas: Solubles en alcohol del 70 al 80%, insolubles en agua, alcohol absoluto y otros solventes neutros, como la Zeína del maíz y la Gliadina del trigo.
Estructura cuaternaria de una proteína globular
3. De acuerdo con su función biológica:
Proteínas estructurales: Forman parte de células y tejidos a los que confieren apoyo estructural. Dentro de estas podemos citar, el colágeno y la elastina presentes en el tejido conectivo de los vertebrados. La queratinas de la piel, pelo y uñas y la espectrina presente en la membrana de los eritrocitos (La espectrina es una de las proteínas más importantes del eritrocito. Su nombre se debe a que si introducimos glóbulos rojos en un medio hipotónico éstos absorben agua y se acaban lisando (estallando). Al lisarse, la hemoglobina sale al exterior de la célula quedando sólo la membrana, lo que se denomina como fantasma de eritrocito. Una de las proteínas del fantasma es la espectrina, y de ahí le viene el nombre) |
 |
Eritrocitos |
Proteínas de transporte: Como su nombre lo indica, transportan sustancias como el oxígeno en el caso de la hemoglobina y la mioglobina, ácidos grasos en el caso de la albúmina de la sangre, o las que realizan un transporte transmembrana en ambos sentidos.
Proteínas de defensa: Protegen al organismo contra posibles ataques de agentes extraños, entre las que se consideran los anticuerpos (inmunoglobulinas) de la fracción gamma globulínica de la sangre, las proteínas denominadas interferones cuya función es inhibir la proliferación de virus en células infectadas e inducir resistencia a la infección viral en otras células, el fibrinógeno de la sangre importante en el proceso de coagulación.
Proteínas hormonales: Se sintetizan en un tipo particular de células pero su acción la ejercen en otro tipo. Ejemplo, la insulina.
Proteínas como factores de crecimiento: Su función consiste en estimular la velocidad de crecimiento y la división celular. Como ejemplo se puede citar la hormona de crecimiento y el factor de crecimiento derivado de plaquetas.
Proteínas catalíticas o enzimas: Permiten aumentar la velocidad de las reacciones metabólicas. Dentro de las células son variadas y se encuentran en cantidad considerable para satisfacer adecuadamente sus necesidades. Entre otras se consideran las enzimas proteolíticas cuya función es la degradación de otras proteínas, lipasas, amilasas, fosfatasas, etc.
Proteínas contráctiles: Son proteínas capaces de modificar su forma, dando la posibilidad a las células o tejidos que estén constituyendo de desplazarse, contraerse, relajarse razón por la cual se encuentran implicadas en los diferentes mecanismos de motilidad. Las proteínas más conocidas de este grupo son la actina y la miosina.
 |
Miosina |
Proteínas receptoras: Proteínas encargadas de combinarse con una sustancia específica. Si se encuentran en la membrana plasmática, son las encargadas de captar las señales externas o simplemente de inspeccionar el medio. Si encuentran en las membranas de los organelos, permiten su interacción. Sin embargo, no son proteínas exclusivas de membrana ya que algunas se encuentran en el citoplasma. El ejemplo más típico de éstas son los receptores de las hormonas esteroides. Casi todos los neurotransmisores, la mayoría de las hormonas y muchos medicamentos funcionan gracias a la presencia de estas proteínas.
Proteínas de transferencia de electrones: Son proteínas integrales de membrana, comunes en las mitocondrias y cloroplastos cuya función se basa en el transporte de electrones desde un donador inicial hasta un aceptor final con liberación y aprovechamiento de energía. Como ejemplo se citan a los Citocromos que hacen parte de la cadena respiratoria.
Las enzimas
Introducción
Los catalizadores (Un catalizador es una sustancia que está presente en una reacción química en contacto físico con los reactivos, y acelera, induce o propicia dicha reacción sin actuar en la misma) aceleran las reacciones químicas, participan en una reacción y experimentan cambios físicos durante ella, pero regresan a su estado original cuando la reacción termina. Mientras que se conocen algunos casos de catálisis por moléculas de ARN, casi todas las enzimas son catalizadores proteínicos. La mayor parte de las reacciones bioquímicas ocurrirían con extrema lentitud sino la catalizaran enzimas. A diferencia de los catalizadores no proteínicos como el H+, OH- o los iones metálicos, cada enzima cataliza un pequeño número de reacciones y frecuentemente sólo una. Las enzimas son así catalizadores altamente específicos de las reacciones. Esencialmente todas las reacciones bioquímicas son catalizadas por enzimas.
Las enzimas hacen posible la vida en la Tierra y de aquí su impacto en numerosos campos de las ciencias biomédicas. Ciertas enfermedades (errores congénitos del metabolismo) se deben a anormalidades en la síntesis de enzimas determinadas por genes.
Cuando las células son lesionadas (por ejemplo, por trastornos de la circulación sanguínea o inflamación), ciertas enzimas pasan al plasma. La medición de su actividad es parte integral del diagnóstico de cierto número de trastornos médicos importantes (infarto de miocardio). La enzimología diagnóstica es el área de la medicina que utiliza enzimas como auxiliares del diagnóstico y el tratamiento. Las enzimas también pueden utilizarse en la terapéutica.
En la actualidad, las industrias utilizan enzimas en la fabricación de diversos productos. Por ejemplo, los jabones para lavar la ropa o los detergentes líquidos contienen enzimas microbianas que degradan los componentes de las manchas.
En las reacciones químicas que ocurren en un ser vivo participan enzimas, un tipo particular de proteínas que fabrican las células y cuya intervención en el metabolismo es fundamental para permitir un funcionamiento eficiente del organismo. ¿Recordás cuál es su función? Acelerar o catalizar las reacciones químicas que, si no fuera así, ocurrirían de manera muy lenta.
La acción de las enzimas
Cada tipo de enzima tiene una forma particular que ¨encaja¨ exactamente con otra molécula (o ión) sobre la cual actúa, a la que se denomina sustrato, es decir que es específica para cada sustrato y reacción. La sacarasa, por ejemplo, cataliza únicamente la ruptura de la sacarosa en glucosa y fructosa, y es incapaz de intervenir en otra reacción química. El reconocimiento espacial entre la enzima (E) y el sustrato (S) hace posible que la enzima cumpla su función.
El receptor para un determinado sustrato se encuentra en un lugar específico de la enzima, denominado sitio activo. Al reconocer el sustrato, se constituye un complejo enzima-sustrato que acelera la reacción química.
Como resultado de la reacción, el sustrato se convierte en el producto, que se separa de la enzima al finalizar el proceso.
En algunos casos, la enzima puede acelerar la degradación del sustrato en dos moléculas, los productos de la reacción. En otros, las enzimas aceleran la unión de sustancias.
Una vez finalizada la reacción, la enzima se recupera y puede volver a actuar. ¿Qué creés que sucede si la molécula enzimática pierde su forma tridimensional? Si eso ocurre, no puede reconocer al sustrato y, por lo tanto, no puede cumplir su función.
Como ejemplo de funcionamiento de las enzimas, consideremos las enzimas del hígado que regulan la síntesis del glucógeno (un polisacárido de reserva energética de los animales formado por hasta 120.000 moléculas de glucosa, su monómero) mediante la acción de la insulina y el glucagón, hormonas proteicas que se producen en el páncreas y actúan sobre el hígado. La insulina estimula la génesis del glucógeno y el glucagón la lisis, es decir la ruptura de la molécula.
La insulina, favorece el ingreso en las células de la glucosa que está en la sangre, con lo que está en la sangre, con lo cual, baja la glucemia. Cuando el aporte de glucosa es abundante, la insulina estimula a los hepatocitos (células del hígado) para que reserven moléculas de glucosa bajo la forma de glucógeno. En este proceso de síntesis (glucogenogénesis) interviene la enzima glucógeno sintetasa. (Esta es solo una de las acciones de la insulina en el hígado).
El glucagón, como también sabés, actúa de manera inversa a la insulina: en respuesta a un descenso de la glucemia, promueve la degradación (ruptura) del glucagón, como también sabés, actúa de manera inversa a la insulina: en respuesta a un descenso de la glucemia, promueve la degradación (ruptura) del glucógeno (glucogenólisis), con ayuda de la activación de la enzima glucógeno fosforilasa, producto de lo cual se obtienen moléculas de glucosa que serán usadas en otros órganos.
Antes de avanzar, recordemos que la insulina y el glucagón son hormonas y, por lo tanto, son mensajeros químicos. Únicamente actúan sobre su órgano blanco porque solo sus células poseen los receptores específicos que las reconocen. Y a partir de aquí se producen complejos procesos dentro de la célula que llevarán a una respuesta. Ahora bien, ¿qué sucede en las células blanco? .El proceso que ocurre dentro de la célula es extremadamente complejo. Podemos simplificarlo de este modo:
- Las hormonas proteicas no pueden entrar en el citoplasma de las células del órgano blanco debido a que son moléculas hidrosolubles. Se les llama ¨primer mensajero¨. Estas hormonas, al unirse a su receptor de membrana (y mediante la activación de otra proteína transductora de señal, la proteína G), inducen la activación de una enzima, la adenilatociclasa, que se encuentra asociada al receptor y situada del lado interno de la membrana.
- La adenilatociclasa es una enzima amplificadora de la señal, cataliza la transformación del ATP en AMP cíclico (AMPc), que actúa como señal interna y se lo llama ¨segundo mensajero¨.
- Estos segundos mensajeros se difunden rápidamente y permiten que la señal se propague por el interior celular. ¿Te das cuenta? El proceso de generación de segundos mensajeros depende de una serie de proteínas de membrana celular. El AMPc activa una proteína enzimática, la proteinquinasa, que iniciará una cascada de reacciones químicas dentro de la célula donde intervienen distintas enzimas. ¿El resultado? La respuesta específica de la célula blanco, por ejemplo, la degradación de glucógeno (glucogenólosis) y el aumento de la glucosa en la sangre.

Clasificación de las enzimas |
Oxidorreductasas | Oxidan y reducen grupos | Citocromos - Transferencias de electrones
Deshidrogenasas - Transferencias de H
Oxidasas - Reacciones con O |
Transferasas | Transfieren grupos. | Quinasas - Fosfato
hidrocarbonados , aldehidos, carboxilo, glucosilo , azufrados , etc |
Hidrolasas | Hidrólisis | Esterasas - Esteres
Carbohidrolasas - Enlaces Glucosídicos
Protidasas - Enlaces Peptídicos
Amidasas - Enlaces C-N |
Liasas | Adición a dobles enlaces | C=C
C=O
C=N |
Isomerasas | Convierten unos isómeros en otros |
|
Ligasas o sintetasas | Forman moléculas orgánicas a partir de otras menores |
|














